21.8.2023
Helena Rintala
Kasvua vai ei kasvua – kas siinä pulma, jonka kanssa moni rakennusterveystutkimuksia tekevä painiskelee. Menetelmiäkin mikrobikasvun toteamiseen alkaa olla tarjolla jo enemmän kuin lääkäri määrää. Rakennusmateriaalin mikrobikasvun toteamiseen käytetään pääasiassa viljelymenetelmiä, mutta qPCR on hivuttautunut rinnalle. Myös mikroskopointia, joko suoraan materiaalista tai teippinäytteestä, sekä Mycometeriä käytetään.
Mikrobioni Oy, sittemmin yrityskaupan myötä Labroc Oy, on ollut edelläkävijä qPCR-menetelmän käyttöönotossa rakennusten mikrobien analysoinnissa. Olemme tehneet paljon vertailua eri menetelmien välillä sekä osana menetelmien validointia että pienimuotoisissa tutkimusprojekteissa. Kokosin tähän kirjoitukseen jonkinlaista yhteenvetoa tähänastisista vertailuista.
Erilaiset tekniikat ja niiden vertailu
Mikrobien viljelyssä on käytössä erilaisia tekniikoita. Perinteinen, mikrobiologiassa paljon käytetty menetelmä on laimennossarjaviljely, jossa mikrobit uutetaan materiaalista puskuriliuokseen, jota laimennetaan ja levitetään kasvatusalustoille. Uudempi ja suoraviivaisempi tekniikka on suoraviljely, jossa hienonnettua materiaalia levitetään suoraan elatusalustalle. Mikrobien DNA:ta mittaavaa qPCR-analyysiä lähdetään yleensä tekemään samanlaisesta uutoksesta kuin laimennossarjaa, jolloin materiaalin mahdollisesti sisältämien inhibiittoreiden vaikutusta analyysiin voidaan vähentää. Solut hajotetaan mekaanisesti ja uutoksesta puhdistetaan DNA, josta määritetään haluttujen mikrobien DNA:n määrä qPCR:n avulla.
Laimennossarjaviljelyn tulos on kvantitatiivinen, kuten myös qPCR-menetelmän tulos. Tämän vuoksi qPCR-analyysi yleensä validoidaan nimenomaan laimennossarjaviljelyyn verraten. Suoraviljelyn ja muiden menetelmien tulosten vertaamista hankaloittaa se, että suoraviljelyn tulos on semikvantitatiivinen, eli ilmoitetaan + – asteikolla nollasta kolmeen tai neljään plussaan. Vertailu menetelmien välillä sujuukin parhaiten vertaamalla eri menetelmillä samasta näytteestä saatujen tulosten tulkintoja keskenään. Tulkintoja vertailtaessa voidaan laskea menetelmän spesifisyys, eli oikeiden negatiivisten (alle tulkintarajan olevien) tulosten prosenttiosuus ja sensitiivisyys, eli oikeiden positiivisten (yli tulkintarajan olevien) tulosten osuus verrattuna referenssimenetelmään, joka on yleensä laimennossarjamenetelmä.
Laimennossarja, suoraviljely ja qPCR
Vertailimme viljely- ja qPCR-menetelmiä muutaman vuoden takaisessa tutkimusaineistossa, jossa oli analysoitu noin 120 pääasiassa ulkoseinärakenteista otettua näytettä sekä laimennos- ja suoraviljelyllä että qPCR:llä. Kun tuloksista laskettiin spesifisyyksiä ja sensitiivisyyksiä eri menetelmille, sensitiivisyys, eli oikeiden positiivisten määrä, oli yli 90% kaikille menetelmille. Spesifisyydessä (oikeiden negatiivisten määrä) oli enemmän vaihtelua, johtuen mm. siitä, että qPCR havaitsee myös kuolleet mikrobit, jolloin pitoisuudet ovat suuremmat. Myös suoraviljelytekniikka saattaa korostaa tiettyjen, paljon itiöitä tuottavien mikrobien määrää. Kaikki kolme menetelmää antoivat saman tulkinnan useimmiten silloin, kun näytteessä ei ollut mikrobikasvua tai siinä oli selvää mikrobikasvua. Tällaisia näytteitä oli 64 %. Alla oleva taulukko eri analyysien tulkintojen kappalemääristä havainnollistaa mielestäni hyvin menetelmien eroja.
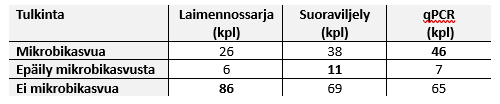
Koska menetelmien käyttämät tekniikat mikrobien määrittämiseen ovat niin erilaisia, ei voi olettaa, että koskaan päästäisiin siihen, että menetelmien tulokset vastaisivat toisiaan sataprosenttisesti. Menetelmiä käyttävien onkin tunnettava kunkin menetelmän ominaisuudet ja tulokseen vaikuttavat tekijät.
Suoramikroskopointi ja qPCR
Kuinka sitten mahtaa suoramikroskopointi asettua tässä menetelmien vertailussa? Tarkastelimme mikroskopoinnin ja qPCR:n suhdetta eräässä aineistossa, jossa näytteistä oli tehty laimennossarjaviljely laboratoriossa ja sen lisäksi qPCR-analyysi. Aineistossa oli 17 näytettä, joista ei viljelyssä löytynyt kuin korkeintaan vähäisiä määriä mikrobeja ja jotka olivat pinnaltaan sellaisia, että niistä sai teippinäytteen. Teippinäytteiden mikroskopoinnissa 13 teipissä havaittiin joko rihmastoa tai rihmastoa ja itiöitä. Alla olevasta taulukosta näkyy, että näytteet, joiden teipissä havaittiin rihmastoa, jakaantuivat qPCR:n suhteen lähes tasan” kasvua”- ja ”ei kasvua” -kategorioihin.
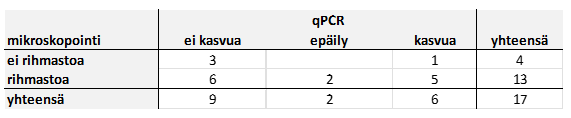
Eli, qPCR:llä määritetty mikrobimäärä näytteessä saattaa olla vähäinen, vaikka teippinäytteessä havaittaisiinkin rihmastoa. Näytemäärä on toki vähäinen tässä validoinnin sivutuotteena syntyneessä aineistossa, joten pitkälle meneviä johtopäätöksiä teippinäytteen hyödyllisyydestä ei vielä tämän perusteella voi tehdä. Epävarmuutta vertailuun tuo se, että teippinäyte otetaan eri kohdasta kuin varsinaiseen analyysiin mennyt näyte. Lisäksi hiivat eivät muodosta rihmastoa, mutta näkyvät qPCR:ssä.
Yhteenvetona voisi sanoa, että meillä kaikilla on vielä opittavaa kunkin menetelmän rajoitteista ja toisaalta hyvistä ominaisuuksista. Positiivista kuitenkin on, että selvät tapaukset tulevat diagnosoitua kaikilla menetelmillä luotettavasti. ”Ei kasvua” – ja ”kasvua” -tulkintojen väliin jäävä alue on se, joka harmaita hiuksia tuottaa, ja jossa meillä on eniten vielä opittavaa; esimerkiksi siinä, mikä on mikrobilajiston merkitys. Onneksi tietoa kuitenkin pikkuhiljaa kertyy.

